Grande pharmacie Moulins
25 Place de la Liberté
03000 Moulins
Lundi - Vendredi : 08h00-20h00
Samedi : 08h00-19h00
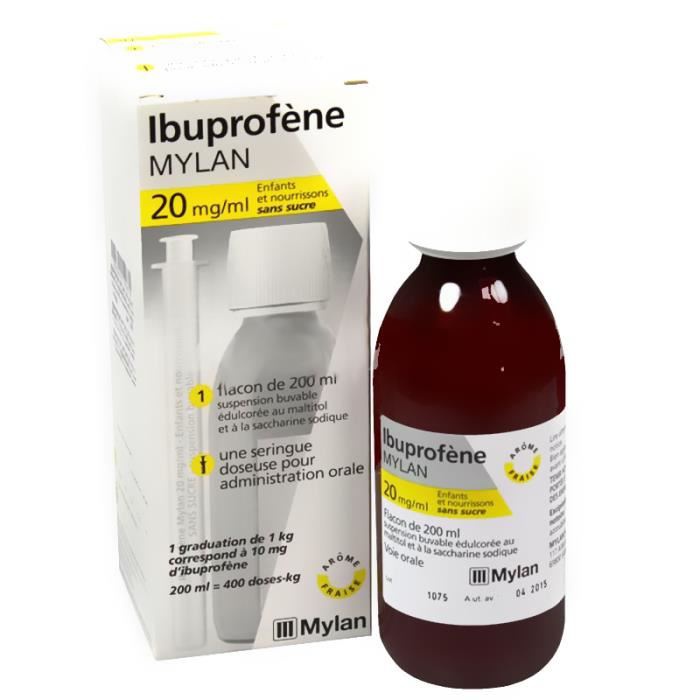
IBUPROFÈNE 20mg/ml Enfants Nourrissons sans Sucre — 200 ml s’utilise dans le traitement symptomatique des affections douloureuses et/ou fébriles ainsi que dans le traitement symptomatique de l’arthrite chronique juvénile.
Prix : 3,38 €
IBUPROFÈNE 20mg/ml Enfants Nourrissons sans Sucre — 200ml de Mylan s’utilise chez l’enfant dans le traitement de courte durée de la fièvre et de la douleur.
Ce médicament est un anti-inflammatoire non stéroïdien (AINS).
Il lutte contre la douleur et fait baisser la fièvre. Ses propriétés anti-inflammatoires se manifestent à forte dose.
Il est utilisé chez l’enfant dans le traitement de courte durée de la fièvre et de la douleur (maux de tête, douleurs dentaires, courbatures...).
Il est également indiqué dans le traitement symptomatique de l’arthrite chronique juvénile.
Enfant de moins de 20 kg : 1 seringue remplie jusqu’à la graduation indiquant le poids de l’enfant, 3 ou 4 fois par jour ;
Enfant de 20 à 30 kg : 1 ou 2 seringues remplies de façon à obtenir au total le poids de l’enfant, 3 ou 4 fois par jour ou 2 comprimés, 3 fois par jour.
En l’absence d’avis médical, la durée du traitement doit être limitée à 5 jours en cas de douleur et 3 jours en cas de fièvre.
Ibuprofène...............................................................20mg
Principes actifs : Ibuprofène
Excipients : Sodium benzoate (E211), Citrique acide (E330), Sodium citrate (E331), Saccharine sodique (E954), Sodium chlorure, Hypromellose (E464), Gomme xanthane (E415), Maltitol, Arôme fraise, Azorubine (E122), Glycérol (E422), Eau purifiée
Ce médicament ne doit pas être utilisé dans les cas suivants :
— antécédent d’allergie ou d’asthme provoqué par la prise d’AINS, y compris l’aspirine ;
— ulcère de l’estomac ou du duodénum ;
— insuffisance hépatique ou rénale graves ;
— insuffisance cardiaque grave ;
— lupus érythémateux disséminé ;
— enfant de moins de 6 ans (comprimé).
Retrouvez toutes les informations concernant la notice d'utilisation et la composition du produit.
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez .

: anti-inflammatoires et anti-rhumatismales non stéroïdien, dérivé de l’acide propionique - code ATC : M01AE01.
Vous devez vous adresser à votre médecin si votre enfant ne ressent aucune amélioration, ou s’il se sent moins bien :
· après 24 heures chez les nourrissons (de 3 mois à 2 ans) ;
· après 3 jours chez les enfants âgés de plus de 2 ans.
Ce médicament contient de l'ibuprofène. Il est indiqué chez les nourrissons de plus de 5 kg (et de plus de 3 mois) et chez les enfants de moins de 12 ans (environ 30 kg), dans le traitement symptomatique :
· de la fièvre et/ou des douleurs telles que maux de tête, états grippaux, douleurs dentaires, courbatures ;
· de l'arthrite chronique juvénile.
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Suspension (Composition pour 1 ml de suspension buvable)
Suspension (Composition pour 1 ml de suspension buvable)
 20 mg
20 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Renouvellement d'inscription (CT) | Le service médical rendu par cette spécialité reste important les indications de l’AMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 12/11/2008 | Inscription (CT) | Absence d’amélioration du service médical rendu par rapport à NUROFENPRO 20 mg/ml ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique. |
ANSM - Mis à jour le : 18/09/2024
IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique
Ibuprofène.......................................................................................................................... 20,0 mg
Pour 1 mL de suspension buvable.
1 graduation de 1 kg correspond à 0,5 mL de suspension buvable et contient 10 mg d'ibuprofène.
Excipients à effet notoire : benzoate de sodium, sodium, maltitol, azorubine (E122).
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension buvable.
Ce médicament est indiqué chez les nourrissons de plus de 5 kg (et de plus de 3 mois) et chez les enfants de moins de 12 ans (environ 30 kg), dans le traitement symptomatique :
· des affections douloureuses et/ou fébriles ;
· de l'arthrite chronique juvénile.
Posologie,
Pour atténuer les symptômes, la dose efficace la plus faible devra être utilisée pendant la durée la plus courte possible (voir rubrique 4.4).
Population pédiatrique
Réservé au nourrisson de plus de 5 kg (et plus de 3 mois) et à l'enfant de moins de 12 ans (environ 30 kg).
La survenue d'effets indésirables peut être minimisée par l'utilisation de la dose la plus faible possible pendant la durée de traitement la plus courte nécessaire au soulagement des symptômes (voir rubrique 4.4).
Nourrissons de moins de 5 kg (ou de moins de 3 mois)
Ce médicament ne doit pas être utilisé chez les enfants de moins de 5 kg (ou de moins de 3 mois) en raison de l’insuffisance des données d’efficacité et de sécurité.
Nourrissons de plus de 5 kg (et de plus de 3 mois) et enfants de moins de 12 ans (environ 30 kg)
Affections douloureuses et/ou fébriles
La posologie usuelle est de 20 à 30 mg/kg/jour en 3 prises par jour (sans dépasser 30 mg/kg/jour).
Les prises systématiques, espacées de 8 heures, permettent d'éviter les oscillations de douleur ou de fièvre.
Un médecin doit être consulté si les symptômes s’aggravent, ou s’ils persistent :
· plus de 24 heures chez le nourrisson de moins de 2 ans ;
· plus de 3 jours chez les enfants de plus de 2 ans.
Arthrite chronique juvénile
La posologie usuelle est de 30 à 40 mg/kg/jour en 4 prises par jour.
Sujets âgés
Ce médicament est destiné au nourrisson et à l'enfant, toutefois en cas d'utilisation chez le sujet âgé, il est à noter que l'âge ne modifiant pas la cinétique de l'ibuprofène, la posologie ne devrait pas avoir à être modifiée en fonction de ce paramètre. Cependant des précautions sont à prendre (voir rubrique 4.4).
Mode d'administration
Voie orale.
Le médicament s'administre au moyen de la seringue pour administration orale (graduée en kg) qui délivre une dose de 10 mg/kg par prise.
L’usage de la seringue pour administration orale est strictement réservé à l’administration d’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique.
La dose à administrer pour 1 prise est obtenue en aspirant la suspension en tirant le piston de la seringue pour administration orale jusqu'à la graduation correspondant au poids de l'enfant.
Pour chaque prise :
· de 5 à 10 kg : remplir la seringue jusqu'à la graduation indiquant le poids de l'enfant ;
· au-delà de 10 kg : remplir une première fois la seringue jusqu'à la graduation 10 kg, puis une deuxième fois jusqu'à atteindre un total égal au poids de l'enfant (exemple pour un enfant de 15 kg: remplir une première fois la seringue jusqu'à graduation 10 kg puis une deuxième fois jusqu'à 5 kg) ;
· au-delà de 30 kg (soit environ 12 ans) : il existe des formes pharmaceutiques plus adaptées.
Instruction pour l'utilisation et la manipulation de la seringue pour administration orale :
· bien agiter le flacon avant l'emploi ;
· le médicament s'administre au moyen de la seringue pour administration orale (graduée en kg) qui délivre une dose de 10 mg/kg par prise ;
· la dose à administrer pour 1 prise est obtenue en aspirant la suspension, en tirant le piston de la seringue pour administration orale jusqu'à la graduation correspondant au poids de l'enfant.
Après chaque utilisation, démonter la seringue pour administration orale, la rincer et la sécher.
L'usage de la seringue pour administration orale est strictement réservé à l'administration de cette suspension pédiatrique d'ibuprofène.
Ce médicament est contre-indiqué dans les situations suivantes :
· hypersensibilité à la substance active ou à l'un des excipients du produit mentionnés à la rubrique 6.1 ;
· patients ayant déjà manifesté des réactions d’hypersensibilité (par exemple antécédents d’asthme, de rhinite, d’œdème de Quincke ou d’urticaire) déclenchés par la prise d'ibuprofène, acide acétylsalicylique (aspirine) ou d’autres médicaments contenant des anti-inflammatoires non stéroïdiens (AINS) ;
· ulcère peptique évolutif, antécédents d'ulcère peptique ou d'hémorragie récurrente (2 épisodes distincts, ou plus, d'hémorragie ou d'ulcération objectivés) ;
· antécédents d'hémorragie ou de perforation digestive au cours d'un précédent traitement par AINS ;
· hémorragie gastro-intestinale, hémorragie cérébro-vasculaire ou autre hémorragie en évolution ;
· insuffisance cardiaque, rénale ou hépatique sévères (voir rubrique 4.4) ;
· lupus érythémateux disséminé,
· grossesse, à partir du début du 6ème mois (24 semaines d’aménorrhée) (voir rubrique 4.6).
Risque de mort fœtale
IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique expose à un risque de mort fœtale même après une seule prise en raison de sa toxicité cardio-pulmonaire (constriction du canal artériel et de la survenue d’un oligoamnios voir rubrique 4.3).
Effets chez l’enfant à naitre
IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique expose également le nouveau-né à un risque d’atteinte rénale (insuffisance rénale), de fermeture prématurée du canal artériel et d’hypertension pulmonaire. Voir rubrique 4.6).
IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique est contre-indiqué chez la femme enceinte à partir du début du 6ème mois de grossesse (24 semaines d'aménorrhée).
En cas de grossesse planifiée ou au cours des 5 premiers mois (avant 24 semaines d'aménorrhée), IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique ne doit être prescrit qu’en cas de nécessité absolue.
Mises en garde spéciales
La survenue d'effets indésirables peut être minimisée par l'utilisation de la dose la plus faible possible pendant la durée de traitement la plus courte nécessaire au soulagement des symptômes (voir rubrique 4.2 et Effets gastro-intestinaux et cardiovasculaires ci-dessous).
Autres AINS
L'utilisation concomitante d’ibuprofène y compris les inhibiteurs sélectifs de la cyclo-oxygénase 2 (cox-2), doit être évitée.
Effets respiratoires
Les patients présentant, ou ayant des antécédents, d’asthme bronchique, rhinite chronique, sinusite chronique, polypose nasale et/ou de maladie allergique ont un risque de manifestation allergique lors de la prise d’acide acétylsalicylique et/ou d’anti-inflammatoires non stéroïdiens plus élevé que le reste de la population.
L’administration de cette spécialité peut entrainer une crise d’asthme notamment chez certains sujets allergiques à l’acide acétylsalicylique ou aux AINS (voir rubrique 4.3).
Sujet âgé
Les sujets âgés présentent un risque accru d'effets indésirables aux AINS, en particulier d'hémorragie gastro-intestinale et de perforations pouvant être fatales (voir rubrique 4.2 et ci-dessous).
Lupus érythémateux disséminé et maladie mixte du tissu conjonctif : en raison du risque accru de méningite aseptique (voir rubrique 4.8).
Effets gastro-intestinaux
Les AINS doivent être administrés avec prudence et sous étroite surveillance chez les malades présentant des antécédents de maladies gastro-intestinales (recto-colite hémorragique, maladie de Crohn), en raison d'un risque d'aggravation de la pathologie (voir rubrique 4.8).
Des hémorragies, ulcérations ou perforations gastro-intestinales parfois fatales, ont été rapportées avec tous les AINS, à n'importe quel moment du traitement, sans qu'il y ait eu nécessairement de signes d'alerte ou d'antécédents d'effets indésirables gastro-intestinaux graves.
Le risque d'hémorragie, d'ulcération ou de perforation gastro-intestinale augmente avec la dose utilisée chez les patients présentant des antécédents d'ulcère, en particulier en cas de complication à type d'hémorragie ou de perforation (voir rubrique 4.3) ainsi que chez le sujet âgé. Chez ces patients, le traitement doit être débuté à la posologie la plus faible possible. Un traitement protecteur de la muqueuse (par exemple misoprostol ou inhibiteur de la pompe à protons) doit être envisagé pour ces patients, comme pour les patients nécessitant un traitement par de faible dose d'acide acétylsalicylique ou traités par d'autres médicaments susceptibles d'augmenter le risque gastro-intestinal (voir ci-dessous et rubrique 4.5).
Les patients présentant des antécédents gastro-intestinaux, surtout s'il s'agit de patients âgés, doivent signaler tout symptôme abdominal inhabituel (en particulier les saignements gastro-intestinaux), notamment en début de traitement.
Une attention particulière doit être portée aux patients recevant des traitements associés susceptibles d'augmenter le risque d'ulcération ou d'hémorragie, comme les corticoïdes administrés par voie orale, les anticoagulants oraux tels que la warfarine, les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les antiagrégants plaquettaires comme l'acide acétylsalicylique (aspirine) (voir rubrique 4.5).
En cas d'apparition d'hémorragie ou d'ulcération survenant chez un patient recevant de l’ibuprofène, le traitement doit être arrêté.
Les AINS doivent être administrés avec prudence et sous étroite surveillance chez les malades présentant des antécédents de maladies gastro-intestinales (recto-colite hémorragique, maladie de Crohn), en raison d'un risque d'aggravation de la pathologie ().
Effets cardiovasculaires et cérébrovasculaires
Une surveillance adéquate et des recommandations sont requises chez les patients présentant des antécédents d'hypertension et/ou d'insuffisance cardiaque légère à modérée, des cas d’hypertension et de rétention hydrosodée et d'œdème ayant été rapportés en association au traitement par AINS.
Les études cliniques suggèrent que l'utilisation de l'ibuprofène, en particulier à dose élevée (2400 mg/jour) est susceptible d'être associée à un risque légèrement accru d'événements thrombotiques artériels (infarctus du myocarde ou accident vasculaire cérébral, par exemple). Dans l'ensemble, les études épidémiologiques ne suggèrent pas que les faibles doses d'ibuprofène (par ex., ≤ 1200 mg/jour) sont associées à un risque accru d'événements thrombotiques artériels.
Les patients présentant une hypertension non contrôlée, une insuffisance cardiaque congestive (NYHA II-III), une ischémie cardiaque établie, une artériopathie périphérique et/ou un accident vasculaire cérébral ne doivent être traités avec de l'ibuprofène qu'après un examen approfondi et les doses élevées (2400 mg/jour) doivent être évitées.
Un examen approfondi doit également être mis en œuvre avant l'instauration d'un traitement à long terme des patients présentant des facteurs de risque d'événements cardiovasculaires (par ex., hypertension, hyperlipidémie, diabète, tabagisme), en particulier si des doses élevées (2400 mg/jour) sont nécessaires.
Des cas de syndrome de Kounis ont été rapportés chez des patients traités par IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique. Le syndrome de Kounis a été défini comme des symptômes cardiovasculaires secondaires à une réaction allergique ou hypersensible associée à une constriction des artères coronaires et pouvant conduire à un infarctus du myocarde.
Dissimulation des symptômes d’une infection sous-jacente
L’ibuprofène peut masquer les symptômes d’une infection, ce qui peut retarder la mise en place d’un traitement adéquat et ainsi aggraver l’évolution de l’infection. C’est ce qui a été observé dans le cas de la pneumonie communautaire d’origine bactérienne et des complications bactériennes de la varicelle. Lorsque l’ibuprofène est administré pour soulager la fièvre ou la douleur liée à l’infection, il est conseillé de surveiller l’infection. En milieu non hospitalier, le patient doit consulter un médecin si les symptômes persistent ou s’ils s’aggravent.
Réactions indésirables cutanées sévères (SCAR)
Des réactions indésirables cutanées sévères (SCAR), tels que la dermatite exfoliative, l’érythème polymorphe, le syndrome de Stevens-Johnson (SJS), la nécrolyse épidermique toxique (TEN), la réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS ou syndrome d’hypersensibilité) et la pustulose exanthématique aiguë généralisée (AGEP), qui peuvent engager le pronostic vital ou être fatales, ont été rapportés en association avec l’utilisation d’ibuprofène (voir rubrique 4.8). La plupart de ces réactions sont survenues au cours du premier mois de traitement.
En cas d’apparition de signes et symptômes évocateurs de ces réactions, la prise d’ibuprofène doit être immédiatement interrompue et un autre traitement doit être envisagé (le cas échéant).
La varicelle peut exceptionnellement être à l'origine de graves complications infectieuses cutanées et des tissus mous. A ce jour, le rôle favorisant des AINS dans l'aggravation de ces infections ne peut être écarté. Il est donc prudent d'éviter l'utilisation d'IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique en cas de varicelle (voir rubrique 4.8).
Insuffisance rénale fonctionnelle
Les AINS, en inhibant l'action vasodilatatrice des prostaglandines rénales, sont susceptibles de provoquer une insuffisance rénale fonctionnelle par diminution de la filtration glomérulaire. Cet effet indésirable est dose dépendant.
Il existe un risque d’insuffisance rénale chez les enfants déshydratés (voir rubrique 4.8).
En début de traitement ou après augmentation de la posologie, une surveillance de la diurèse et de la fonction rénale est recommandée chez les patients présentant les facteurs de risque suivants :
· sujets âgés ;
· médicaments associés tels que: IEC, sartans, diurétiques (voir rubrique 4.5) ;
· hypovolémie quelle qu'en soit la cause ;
· insuffisance cardiaque ;
· insuffisance rénale chronique ;
· syndrome néphrotique ;
· néphropathie lupique ;
· cirrhose hépatique décompensée.
Rétention hydro-sodée
Rétention hydro-sodée avec possibilité d'œdèmes, d'HTA ou de majoration d'HTA, d'aggravation d'insuffisance cardiaque. Une surveillance clinique est nécessaire, dès le début de traitement en cas d'HTA ou d'insuffisance cardiaque. Une diminution de l'effet des antihypertenseurs est possible (voir rubrique 4.5).
Hyperkaliémie
Hyperkaliémie favorisée par le diabète ou un traitement concomitant par des médicaments hyperkaliémiants (voir rubrique 4.5).
Une surveillance régulière de la kaliémie doit être effectuée dans ces circonstances.
La prise de ce médicament doit être évitée en cas de traitement avec un autre anti-inflammatoire non stéroïdien, avec un anticoagulant oral, avec du lithium, avec de l'acide acétylsalicylique à doses antalgiques, antipyrétiques ou anti-inflammatoires, avec du méthotrexate à des doses supérieures à 20 mg par semaine, avec les héparines de bas poids moléculaire et apparentés et les héparines non fractionnées (aux doses curatives et/ou chez le sujet âgé), avec le pémétrexed, chez les patients ayant une fonction rénale faible à modérée (voir rubrique 4.5).
Effets hépatiques
Dysfonctionnements hépatiques (voir rubriques 4.3 et 4.8).
Précautions d'emploi
L'ibuprofène, comme tout médicament inhibiteur de la synthèse des cyclo-oxygénases et des prostaglandines, peut altérer la fertilité. Cet effet est réversible à l’arrêt du traitement. Son utilisation n'est pas recommandée chez les femmes qui souhaitent concevoir un enfant.
Au niveau visuel : en cas de troubles de la vue apparaissant en cours de traitement, un examen ophtalmologique complet doit être effectué.
Au niveau rénal et hépatique : en cas de traitement prolongé, il est recommandé de contrôler la formule sanguine, les fonctions hépatiques et rénales.
Excipients
Ce médicament contient 3,79 mg de sodium (composant principal du sel de cuisine) par ml de suspension buvable. A prendre en compte chez les patients suivant un régime hyposodé strict. Ce médicament contient 0,5 mg de benzoate de sodium par graduation de 1 kg. Le benzoate de sodium peut accroître le risque d’ictère (jaunissement de la peau et des yeux) chez les nouveau-nés (jusqu’à 4 semaines).
Ce médicament contient du sirop de glucose hydrogéné (ou maltitol liquide). Les patients présentant des problèmes héréditaires rares d’intolérance au fructose ne doivent pas prendre ce médicament.
Ce médicament contient un agent colorant azoïque (azorubine E122) et peut provoquer des réactions allergiques.
Risque lié à l'hyperkaliémie
Certains médicaments ou classes thérapeutiques sont susceptibles de favoriser la survenue d'une hyperkaliémie : les sels de potassium, les diurétiques hyperkaliémiants, les inhibiteurs de l'enzyme de conversion, les antagonistes de l'angiotensine II, les anti-inflammatoires non stéroïdiens, les héparines (de bas poids moléculaires ou non fractionnées), les immunosuppresseurs comme la ciclosporine ou le tacrolimus, le triméthoprime.
L'association de ces médicaments majore le risque d'hyperkaliémie. Ce risque est particulièrement important avec les diurétiques épargneurs de potassium, notamment lorsqu'ils sont associés entre eux ou avec des sels de potassium, tandis que l'association d'un IEC et d'un AINS, par exemple, est à moindre risque dès l'instant que sont mises en œuvre les précautions recommandées.
Pour connaître les risques et les niveaux de contraintes spécifiques aux médicaments hyperkaliémiants, il convient de se reporter aux interactions propres à chaque substance.
Toutefois certaines substances, comme le triméthoprime, ne font pas l'objet d'interactions spécifiques au regard de ce risque. Néanmoins, ils peuvent agir comme facteurs favorisants lorsqu'ils sont associés à d'autres médicaments comme ceux sus mentionnés.
L'administration simultanée d'ibuprofène avec les produits suivants nécessite une surveillance rigoureuse de l'état clinique et biologique du malade :
· Association au mifamurtide
Aux doses élevées d’AINS, risque de moindre efficacité du mifamurtide.
Associations déconseillées
· Acide acétylsalicylique (aspirine)
A doses anti-inflammatoires (≥ 1 g par dose et/ou ≥ 3 g par jour) ou à doses antalgiques ou antipyrétiques (≥ 500 mg par dose et/ou < 3 g par jour) : Majoration du risque ulcérogène et hémorragique digestif.
· Autres AINS y compris les inhibiteurs sélectifs de la cyclo-oxygénase 2
Eviter l’utilisation concomitante de deux ou de plusieurs AINS car cela peut augmenter le risque d’effets indésirables et augmente le risque ulcérogène et le risque d’hémorragie gastro-intestinal (voir rubrique 4.4).
· Héparines non fractionnées, héparines de bas poids moléculaire et apparentés (à doses curatives et/ou chez le sujet âgé)
Augmentation du risque hémorragique (agression de la muqueuse gastroduodénale par les AINS). Si l'association ne peut être évitée, surveillance clinique étroite.
· Anticoagulants oraux
Augmentation du risque hémorragique de l'anticoagulant oral (agression de la muqueuse gastroduodénale par les AINS). Les AINS sont susceptibles de majorer les effets des anticoagulants, comme la warfarine et les héparines de bas poids moléculaires et apparentés et les héparines non fractionnées (à doses curatives et/ou sujets âgés (voir rubrique 4.4)). Si l'association ne peut être évitée, surveillance clinique et biologique étroite.
· Lithium
Augmentation de la lithémie pouvant atteindre des valeurs toxiques (diminution de l'excrétion rénale du lithium).
Si l'association ne peut être évitée, surveiller étroitement la lithémie et adapter la posologie du lithium pendant l'association et après l'arrêt de l'AINS.
· Méthotrexate, utilisé à des doses supérieures à 20 mg/semaine
Augmentation de la toxicité notamment hématologique du méthotrexate (diminution de la clairance rénale du méthotrexate par les anti-inflammatoires).
· Pémétrexed (patients ayant une fonction rénale faible à modérée, clairance de la créatinine comprise entre 45 ml/min et 80 ml/min)
Risque de majoration de la toxicité du pémétrexed (diminution de la clairance rénale par les AINS).
· Nicorandil
Majoration du risque ulcérogène et hémorragique digestif.
faisant l'objet de précautions d’emploi
· Ciclosporine, tacrolimus
Risque d'addition des effets néphrotoxiques, notamment chez le sujet âgé. Surveiller la fonction rénale en début de traitement par l'AINS.
· Antihypertenseur : Inhibiteurs de l'enzyme de conversion (IEC), antagonistes de l'angiotensine II (ARA II)
Risque d’insuffisance rénale aigüe chez le patient à risque (sujet âgé, déshydratation, traitement associé avec diurétiques, altération de la fonction rénale), par diminution de la filtration glomérulaire (inhibition des prostaglandines vasodilatatrices due aux AINS). Ces effets sont généralement réversibles. Par ailleurs, réduction de l’effet anti-hypertenseur.
Hydrater le malade et surveiller la fonction rénale en début de traitement et régulièrement pendant l’association.
· Diurétiques
Risque d’insuffisance rénale aigüe chez le patient à risque (sujet âgé et/ou déshydraté), par diminution de la filtration glomérulaire (inhibition des prostaglandines vasodilatatrices due aux AINS). Par ailleurs, réduction de l’effet anti-hypertenseur.
Hydrater le malade et surveiller la fonction rénale en début de traitement.
· Méthotrexate, utilisé à des doses inférieures ou égales à 20 mg/semaine
Augmentation de la toxicité notamment hématologique du méthotrexate (diminution de la clairance rénale du méthotrexate par les anti-inflammatoires).
Contrôle hebdomadaire de l'hémogramme durant les premières semaines de l'association.
Surveillance accrue en cas d'altération (même légère) de la fonction rénale, ainsi que chez le sujet âgé.
· Pémétrexed (patients ayant une fonction rénale normale)
Risque de majoration de la toxicité du pémétrexed (diminution de la clairance rénale par les AINS).
Surveillance biologique de la fonction rénale.
· Glycosides cardiotoniques
Les AINS peuvent aggraver l’insuffisance cardiaque, réduire le taux de filtration glomérulaire et augmenter le niveau des glycosides plasmatiques.
· Corticoïdes
Augmentation du risque d’ulcération gastro-intestinale ou de saignement (voir rubrique 4.4).
· Mifépristone
Les AINS ne doivent pas être utilisés durant 8 à 12 jours suivant l’administration du mifépristone, car les AINS peuvent réduire l’effet de la mifépristone.
· Zidovudine
Augmentation du risque de toxicité hématologique lorsque les AINS sont administrés avec la zidovudine. Il existe des preuves d’un risque accru d’hémarthroses et des hématomes chez les hémophiles VIH (positif) recevant un traitement concomitant par la zidovudine et l’ibuprofène.
· Antibiotiques de la famille des quinolones
Les données chez l’animal indiquent que les AINS peuvent augmenter le risque de convulsions lorsqu’ils sont associés aux antibiotiques de la famille des quinolones. Les patients prenant des AINS et des quinolones peuvent avoir un risque accru de développer des convulsions.
· Cobimétinib
Augmentation du risque hémorragique. Surveillance clinique.
· Ténofovir disoproxil
Risque de majoration de la néphrotoxicité du ténofovir, notamment avec des doses élevées de l’anti-inflammatoire ou en présence de facteurs de risque d’insuffisance rénale. En cas d’association, surveiller la fonction rénale.
· Acide acétylsalicylique à des doses anti-agrégantes (de 50 mg à 375 mg par jour en 1 ou plusieurs prises)
Majoration du risque ulcérogène et hémorragique digestif.
De plus, des données expérimentales suggèrent que l'ibuprofène peut inhiber l'effet antiagrégant plaquettaire d'une faible dose d'acide acétylsalicylique lorsqu'ils sont pris de façon concomitante. Toutefois, les limites de ces données ex vivo et les incertitudes quant à leur extrapolation en clinique, ne permettent pas d'émettre de conclusion formelle pour ce qui est de l'usage régulier de l'ibuprofène ; par ailleurs, en ce qui concerne l'ibuprofène utilisé de façon occasionnelle, la survenue d'un effet cliniquement pertinent apparaît peu probable.
· Antiagrégants plaquettaires et inhibiteurs sélectifs de la recapture de la sérotonine (ISRS)
Majoration du risque d'hémorragie gastro-intestinale (voir rubrique 4.4).
· Bêta-bloquants (sauf esmolol)
Réduction de l'effet antihypertenseur (inhibition des prostaglandines vasodilatatrices par les AINS et rétention hydrosodée avec les AINS pyrazolés).
· Déférasirox
Majoration du risque ulcérogène et hémorragique gastro-intestinal.
· Glucocorticoïdes (sauf hydrocortisone en traitement substitutif)
Augmentation du risque d'ulcération et d'hémorragie gastro-intestinale (voir rubrique 4.4).
· Héparines de bas poids moléculaire et apparentés et héparines non fractionnées (aux doses préventives)
Augmentation du risque hémorragique.
· Médicaments mixtes adrénergiques-sérotoninergiques
Augmentation du risque hémorragique.
· Pentoxifylline
Majoration du risque hémorragique.
Grossesse
A partir du début du 6ème mois de grossesse (24 semaines d'aménorrhée) : toute prise de IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique, même ponctuelle, est contre-indiquée. Une prise même unique à partir de 24 semaines d’aménorrhée justifie un contrôle échographique cardiaque et rénal du fœtus et/ou du nouveau-né.
Sauf nécessité absolue, IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique ne doit pas être prescrit chez une femme qui envisage une grossesse ou au cours des 5 premiers mois de grossesse (avant 24 semaines d’aménorrhée). Le cas échéant, la dose devra être la plus faible possible et la durée du traitement la plus courte possible. Une prise prolongée est fortement déconseillée.
En cas de prise à partir de la 20ème semaine d’aménorrhée, une surveillance cardiaque et rénale du fœtus pourrait s’avérer nécessaire.
En cas de survenue d'oligoamnios, ou de constriction du canal artériel, le traitement par IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique doit être interrompu.
L’inhibition de la synthèse des prostaglandines par les AINS peut affecter le déroulement de la grossesse et/ou le développement de l’embryon ou du fœtus.
Risques associés à l’utilisation au cours du 1er trimestre
Des études épidémiologiques suggèrent qu’un traitement par un inhibiteur de la synthèse des prostaglandines au cours du 1er trimestre de grossesse est associé à une augmentation du risque de fausse-couche.
Pour certains AINS, un risque augmenté de malformations cardiaques et de la paroi abdominale (gastroschisis) est également décrit. Le risque absolu de malformation cardiovasculaire fœtale est passé de moins de 1% à approximativement 1,5% en cas d’exposition au 1er trimestre. Le risque paraît augmenter en fonction de la dose et de la durée du traitement.
Chez l’animal, l’administration d’un inhibiteur de la synthèse des prostaglandines au cours de la phase d’organogénèse provoque une perte pré et post-implantatoire accrue, une augmentation de la létalité embryo-fœtale et une incidence supérieure de certaines malformations, y compris cardiovasculaires.
Risques associés à l’utilisation au cours du 2ème et 3ème trimestre
· A partir de la 12ème semaine d’aménorrhée
La prise maternelle d’un AINS expose le fœtus à un risque d’atteinte fonctionnelle rénale :
o In utero (mise en route de la diurèse fœtale): un oligoamnios peut survenir peu de temps après le début du traitement. Celui-ci est généralement réversible à l'arrêt du traitement. Il peut se compliquer d’un anamnios en particulier lors d'une exposition prolongée à un AINS.
o A la naissance : une insuffisance rénale (réversible ou non) peut être observée voire persister surtout en cas d'exposition tardive et prolongée avec un risque d'hyperkaliémie sévère retardée.
· A partir de la 20ème semaine d’aménorrhée :
En plus de l’atteinte fonctionnelle rénale (cf. supra), la prise maternelle d’un AINS expose le fœtus à un risque de constriction du canal artériel (le plus souvent réversible à l’arrêt du traitement).
· A partir de la 24ème semaine d’aménorrhée :
Le risque de toxicité cardio-pulmonaire (fermeture prématurée du canal artériel et hypertension artérielle pulmonaire) devient plus important et peut conduire à une insuffisance cardiaque droite fœtale ou néonatale voire à une mort fœtale in utero. Ce risque est d'autant plus important et moins réversible que la prise est proche du terme. Cet effet existe même pour une prise ponctuelle
En fin de grossesse (proche du terme), la prise d’AINS expose également la mère et le nouveau-né à :
- un allongement du temps de saignement du fait d’une action anti-agrégante pouvant survenir même après administration de très faibles doses de médicament ;
- une inhibition des contractions utérines entraînant un retard de terme ou un accouchement prolongé.
Allaitement
Les A.I.N.S. passant dans le lait maternel, ce médicament est déconseillé chez la femme qui allaite.
Fertilité
Comme tous les AINS, l'utilisation de ce médicament peut temporairement altérer la fertilité féminine en agissant sur l’ovulation ; il est donc déconseillé chez les femmes souhaitant concevoir un enfant. Chez les femmes rencontrant des difficultés pour concevoir ou réalisant des tests de fertilité, l'arrêt du traitement doit être envisagé.
Prévenir les patients de l'apparition possible de vertiges et de troubles de la vue.
La liste des effets indésirables suivants se rapporte à ceux provoqués par l’ibuprofène à la dose maximale de 1200 mg maximum par jour, pour une utilisation de courte durée. Dans le cas de traitement chronique, il est rappelé que l’ibuprofène peut entrainer la survenue d’effets indésirables supplémentaires lors d’une utilisation prolongée. Des études cliniques et des données épidémiologiques suggèrent que l'utilisation de l'ibuprofène, surtout lorsqu'il est utilisé à dose élevée (supérieure ou égale à 2400 mg par jour) et sur une longue durée de traitement, peut être associée à une légère augmentation du risque d'évènement thrombotique artériel (par exemple, infarctus du myocarde ou accident vasculaire cérébral) (voir rubrique 4.4).
Bien qu’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique ne soit pas indiqué en traitement de longue durée, il est rappelé que l’ibuprofène peut entraîner la survenue d’effets indésirables supplémentaires lors d’une utilisation prolongée.
Les effets indésirables qui ont été associés à l’ibuprofène sont donnés ci-dessous, répertoriés par classe de système organique et par fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 et < 1/10), peu fréquent (≥ 1/1000 et < 1/100), rare (≥ 1/10000 et <
1/1000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimé sur la base de données disponibles).
Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Les évènements indésirables les plus fréquemment observés sont de nature gastro-intestinale. Les événements indésirables sont le plus souvent dose-dépendants, en particulier le risque de survenue d’hémorragie gastro-intestinale, qui dépend de la posologie et de la durée du traitement.
Les effets indésirables sont moins fréquents lorsque la dose maximale quotidienne est de 1200 mg.
|
Classe système organique |
Fréquence |
Effet(s) indésirable(s) |
|
Affections du système sanguin et lymphatique |
Très rare |
Troubles hématopoïétiques2 |
|
Affections du système immunitaire |
Peu fréquent |
Des réactions d'hypersensibilité comprenant : urticaire et prurit3 |
|
Très rare |
Réactions d'hypersensibilité sévères incluant gonflement du visage, de la langue et du larynx, dyspnée, tachycardie, hypotension (anaphylaxie, œdème de Quincke ou choc sévère)3 |
|
|
Affections du système nerveux |
Peu fréquent |
Céphalées |
|
Très rare |
Méningite aseptique4 |
|
|
Fréquence indéterminée |
Vertiges |
|
|
Affections oculaires |
Fréquence indéterminée |
Troubles visuels |
|
Affections cardiaques |
Fréquence indéterminée |
Insuffisance cardiaque et œdème5 |
|
Fréquence indéterminée |
Syndrome de Kounis |
|
|
Affections vasculaires |
Fréquence indéterminée |
Hypertension5 |
|
Affections respiratoires, thoraciques et médiastinales |
Fréquence indéterminée |
Réactivité du tractus respiratoire comprenant asthme, bronchospasme ou dyspnée3 |
|
Affections gastro-intestinales |
Peu fréquent |
Douleurs abdominales, des nausées et dyspepsie6 |
|
Rare |
Diarrhée, flatulence, constipation et vomissements |
|
|
Très rare |
Ulcères peptiques, perforations ou hémorragies gastro-intestinales, méléna et hématémèse7. Stomatite ulcérative, gastrite |
|
|
Fréquence indéterminée |
Exacerbation de la maladie de Crohn et colite8 |
|
|
Affections hépatobiliaires |
Très rare |
Dysfonctionnement hépatique |
|
Fréquence indéterminée |
Hépatite, élévation des transaminases |
|
|
Affections de la peau et du tissu cutané |
Peu fréquent |
Eruptions cutanées3 |
|
Très rare |
Réactions indésirables cutanées sévères (SCAR) (y compris érythème polymorphe, dermatite exfoliative, syndrome de Stevens-Johnson, nécrolyse épidermique toxique et syndrome de Lyell).1 |
|
|
Fréquence indéterminée |
Réaction d’hypersensibilité médicamenteuse avec éosinophilie et symptômes systémiques (DRESS ou syndrome d’hypersensibilité) Pustulose exanthématique aiguë généralisée (PEAG), réaction de photosensibilité. |
|
|
Troubles rénaux et urinaires |
Très rare |
Insuffisance rénale aiguë9 |
|
Fréquence indéterminée |
Insuffisance rénale, oligurie |
|
|
Investigations |
Très rare |
Diminution du taux d’hémoglobine |
Descriptions des effets indésirables spécifiques
1 Dans des cas exceptionnels, apparition d'infections graves de la peau et infections des tissus mous dans les cas de varicelle et du zona (voir rubrique 4.4).
2 Celles-ci incluent l’anémie, la leucopénie, la thrombocytopénie, la pancytopénie et l’agranulocytose.
Les premiers signes sont la fièvre, les maux de gorge, les ulcères superficiels de la bouche, des symptômes pseudo-grippaux, l'épuisement sévère, des saignements inexpliqués et des ecchymoses.
3 Réactions d’hypersensibilité : Celles-ci peuvent consister en : (a) réactions anaphylactiques et allergiques non spécifiques, (b) hyperactivité bronchique comprenant l’asthme, l’asthme aggravé, un bronchospasme ou une dyspnée (l’apparition de crises d’asthme chez certains patients peut être liée à une allergie à l’acide acétylsalicylique ou à un AINS, voir rubrique 4.3), ou (c) atteintes cutanées diverses incluant, prurit, urticaire, purpura, œdème de Quincke, et plus rarement, des dermatoses exfoliatives et bulleuses (y compris nécrolyse épidermique toxique, syndrome de Stevens Johnson et érythème polymorphe).
4 Le mécanisme pathogénique de la méningite aseptique induite par les médicaments n’est pas complètement élucidé. Les données disponibles sur la méningite aseptique induite par les AINS suggèrent l’existence d’une possible corrélation entre la prise de médicament, l’apparition d’une méningite aseptique et la disparition de celle-ci à l’arrêt du traitement. Des cas isolés de symptômes de méningites aseptiques (tels que raideur de la nuque, maux de tête, nausées, vomissements, fièvre ou désorientations) ont été observés pendant le traitement avec l’ibuprofène chez les patients présentant des troubles auto-immuns (tels que le lupus érythémateux disséminé ou la connectivite).
La découverte d’une méningite aseptique doit conduire à la recherche d’un lupus érythémateux disséminé ou d’une connectivite.
5 Des études cliniques et des données épidémiologiques suggèrent que l'utilisation de l'ibuprofène, surtout lorsqu’il est utilisé à dose élevée (2400 mg par jour) et sur une longue durée de traitement, peut être associée à une légère augmentation du risque d'événement thrombotique artériel (par exemple, infarctus du myocarde ou accident vasculaire cérébral) (voir rubrique 4.4).
6 Les effets indésirables les plus fréquemment observés sont de nature gastro-intestinale.
7 D’apparition souvent fatale, particulièrement chez le sujet âgé.
8 Voir section 4.4.
9 En particulier en cas de traitement de longue durée, associé à une augmentation de l’urémie et œdème. Comprend également une nécrose papillaire.
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :
Une utilisation prolongée à des doses supérieures à celles recommandées ou un surdosage peuvent entraîner une acidose tubulaire rénale et une hypokaliémie.
Chez les enfants, l’ingestion de plus de 400 mg/kg peut provoquer des symptômes. Chez l’adulte, l’effet dose-réponse est moins tranché. La demi-vie, en cas de surdosage, est de 1,5-3 heures.
Symptômes : La plupart des patients, ayant ingéré des quantités cliniquement importantes d’AINS, ne développeront pas plus que des nausées, vomissements, douleurs épigastriques, ou plus rarement diarrhée. Acouphène, maux de tête et saignements gastro-intestinaux sont également possibles. En cas d’intoxication plus grave, la toxicité se manifeste au niveau du système nerveux central par des vertiges, de la somnolence, parfois de l’excitation et une désorientation ou encore un coma. Parfois les patients développent des convulsions. En cas d’intoxication grave, une acidose métabolique peut survenir. Le temps de prothrombine/INR peut être prolongé, sans doute à cause d’interférences avec les actions en circulation de facteur de coagulation. Une insuffisance rénale, une atteinte hépatique, une hypotension, une dépression respiratoire et une cyanose peuvent se produire. L’exacerbation de l’asthme est possible chez les asthmatiques.
Prise en charge du surdosage : transfert immédiat à l’hôpital. Il n’existe pas d’antidote. Le traitement doit être symptomatique et comprendre le dégagement des voies respiratoires et la surveillance des signes cardiaques et des signes vitaux jusqu’à leur stabilisation. Envisager l’administration orale de charbon actif ou la vidange gastrique si le patient présente une quantité potentiellement toxique dans l’heure suivant l’ingestion. Si les convulsions sont fréquentes ou prolongées, elles doivent être traitées par le diazépam ou le lorazépam par voie intraveineuse. Traiter l’asthme avec des bronchodilatateurs.
Classe pharmacothérapeutique : anti-inflammatoires et anti-rhumatismales non stéroïdien, dérivé de l’acide propionique, code ATC : M01AE01.
Effets pharmacodynamiques
L'ibuprofène est un anti-inflammatoire non stéroïdien, appartenant au groupe des propioniques, dérivé de l'acide aryl carboxylique. Il possède les propriétés suivantes :
· propriété antalgique ;
· propriété antipyrétique ;
· propriété anti-inflammatoire ;
· propriété d'inhibition de courte durée des fonctions plaquettaires.
L'ensemble de ces propriétés est lié à une inhibition de la synthèse des prostaglandines.
Efficacité et sécurité clinique
Les données expérimentales suggèrent que l'ibuprofène inhibe de façon compétitive l'effet des faibles doses d'acide acétylsalicylique sur l'agrégation plaquettaire en cas d'administration concomitante. Des études pharmacodynamiques montrent que quand des doses uniques d'ibuprofène 400 mg ont été prises dans les 8 h qui précèdent ou dans les 30 min suivant l'administration d'acide acétylsalicylique à libération immédiate (81 mg), une diminution de l'effet de l'acide acétylsalicylique sur la formation du thromboxane ou sur l'agrégation plaquettaire se produit.
Bien qu'il existe des incertitudes en ce qui concerne l'extrapolation de ces données aux situations cliniques, la possibilité qu'une utilisation d'ibuprofène régulière, à long terme, soit susceptible de réduire l'effet cardioprotecteur des faibles doses d'acide acétylsalicylique ne peut pas être exclue. Aucun effet cliniquement pertinent n'est considéré comme probable en cas d'utilisation occasionnelle d'ibuprofène (voir rubrique 4.5).
Absorption
La concentration sérique maximale est atteinte 1 heure environ après administration par voie orale.
Après prise unique, les concentrations sériques maximales sont proportionnelles à la dose (Cmax entre 25 et 50 µg/ml pour la dose de 10 mg/kg).
L'alimentation retarde l'absorption de l'ibuprofène.
Distribution
La demi-vie d'élimination est de 1 à 2 heures environ.
L'administration de l'ibuprofène ne donne pas lieu à des phénomènes d'accumulation. Il est lié aux protéines plasmatiques dans la proportion de 99 pour cent.
Dans le liquide synovial, on retrouve l'ibuprofène avec des concentrations stables entre la deuxième et la huitième heure après la prise, la Cmax synoviale étant environ égale au tiers de la Cmax plasmatique.
Biotransformation
Suivant le métabolisme hépatique (hydroxylation, carboxylation, conjugaison), l'ibuprofène n'a pas d'effet inducteur enzymatique. Il est métabolisé pour 90 % sous forme de métabolites pharmacologiquement inactifs.
Élimination
L'élimination est essentiellement urinaire. Elle est totale en 24 heures, à raison de 10 % sous forme inchangée et de 90 % sous forme de métabolites inactifs, essentiellement glucoroconjugués.
La demi-vie d'élimination est de 2 heures environ (allant de 1,8 à 3,5 heures).
Les paramètres cinétiques de l'ibuprofène sont peu modifiés chez le sujet âgé, chez l'insuffisant rénal et chez l'insuffisant hépatique. Les perturbations observées ne justifient pas une modification de la posologie.
Sans objet.
Benzoate de sodium, acide citrique anhydre, citrate de sodium, saccharine sodique, chlorure de sodium, hypromellose, gomme xanthane, maltitol liquide, arôme fraise, azorubine (E122), glycérol, eau purifiée.
Sans objet.
3 ans
Pas de précautions particulières de conservation.
150 mL ou 200 mL en flacon ambré (PET), bouchon sécurité enfant (PEHD/PEBD) et fond de bouchon (PEBD) avec seringue doseuse (PE/polystyrène) ou Cuillère doseuse graduée à 2,5 mL et 5 mL en polypropylène blanc ou en polystyrène blanc.
Toutes les présentations peuvent ne pas être commercialisées.
Pas d'exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
· 34009 386 617 7 4 : 150 mL en flacon (PET) avec seringue pour administration orale (polypropylène)
· 34009 386 618 3 5 : 200 mL en flacon (PET) avec seringue pour administration orale (polypropylène)
· 34009 386 620 8 5 : 150 mL en flacon (PET) avec cuillère doseuse graduée (polypropylène)
· 34009 386 621 4 6 : 200 mL en flacon (PET) avec cuillère doseuse graduée (polypropylène)
Sans objet.
Sans objet.
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 18/09/2024
ATTENTION
IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique QUI EST UN ANTI-INFLAMMATOIRE NON STEROIDIEN (AINS) PEUT ENTRAINER UNE MORT FŒTALE S’IL EST PRIS A PARTIR DU 6EME MOIS DE GROSSESSE (24 semaines d’aménorrhée) MEME APRES UNE SEULE PRISE.
N’utilisez pas ce médicament si vous êtes enceinte de 6 mois et plus (24 semaines d’aménorrhée et plus).
Avant le 6ème mois ou si vous envisagez une grossesse, vous ne devez pas prendre ce médicament, sauf en cas d’absolue nécessité déterminée par votre médecin.
IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique
Ibuprofène
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, votre pharmacien ou votre infirmier/ère.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si votre nourrisson (3 mois à 2 ans) se sent moins bien, ou s’il ne ressent aucune amélioration après 24 heures.
· Vous devez vous adresser à votre médecin si votre enfant (2 à 12 ans) se sent moins bien ou ne ressent aucune amélioration après 3 jours.
1. Qu'est-ce qu’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique ?
3. Comment prendre IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique ?
: anti-inflammatoires et anti-rhumatismales non stéroïdien, dérivé de l’acide propionique - code ATC : M01AE01.
Vous devez vous adresser à votre médecin si votre enfant ne ressent aucune amélioration, ou s’il se sent moins bien :
· après 24 heures chez les nourrissons (de 3 mois à 2 ans) ;
· après 3 jours chez les enfants âgés de plus de 2 ans.
Ce médicament contient de l'ibuprofène. Il est indiqué chez les nourrissons de plus de 5 kg (et de plus de 3 mois) et chez les enfants de moins de 12 ans (environ 30 kg), dans le traitement symptomatique :
· de la fièvre et/ou des douleurs telles que maux de tête, états grippaux, douleurs dentaires, courbatures ;
· de l'arthrite chronique juvénile.
Ne prenez jamais IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique si vous êtes enceinte de 24 semaines d’aménorrhée et plus (6 mois et plus de grossesse) (voir ci-dessous « Grossesse, allaitement et fertilité »).
Au cours des 5 premiers mois de grossesse, vous ne devez pas prendre IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique, sauf en cas d’absolue nécessité qui est déterminée par votre médecin.
Si vous envisagez une grossesse et que vous prenez un AINS, parlez-en à un professionnel de la santé.
Ne prenez jamais IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique :
· si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· en cas d’antécédents d'allergie ou d'asthme déclenchés par la prise de ce médicament ou d'un médicament apparenté, notamment autres anti-inflammatoires non stéroïdiens, acide acétylsalicylique (aspirine), rhinite, gonflement ou urticaire ;
· si vous êtes enceinte, à partir du début du 6ème mois de grossesse (au-delà de 24 semaines d’aménorrhée) ;
· en cas d’antécédents de saignements gastro-intestinaux ou d'ulcères liés à des traitements antérieurs par AINS ;
· en cas d’ulcère ou saignement de l'estomac ou de l'intestin en évolution ou récidivant ;
· en cas d’hémorragie gastro-intestinale, hémorragie cérébrale ou autre hémorragie en cours ;
· en cas de maladie grave du foie ;
· en cas de maladie grave des reins ;
· en cas de maladie grave du cœur ;
· en cas de lupus érythémateux disséminé.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant de prendre IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique.
A forte dose, supérieure à 1200 mg/jour, ce médicament possède des propriétés anti-inflammatoires et peut provoquer des inconvénients parfois graves qui sont ceux observés avec les médicaments anti-inflammatoires non-stéroïdiens.
Les médicaments tels qu’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique pourraient augmenter le risque de crise cardiaque (« infarctus du myocarde ») ou d'accident vasculaire cérébral. Le risque est d'autant plus important que les doses utilisées sont élevées et la durée de traitement prolongée.
Les médicaments tels qu’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique pourraient provoquer un bronchospasme chez les patients souffrant ou ayant des antécédents d’asthme bronchique ou de maladie allergique.
Ne pas dépasser les doses recommandées ni la durée de traitement.
Si vous avez des problèmes cardiaques, si vous avez eu un accident vasculaire cérébral ou si vous pensez avoir des facteurs de risque pour ce type de pathologie (par exemple en cas de pression artérielle élevée, de diabète, de taux de cholestérol élevé ou si vous fumez), veuillez en parler avec votre médecin ou à votre pharmacien.
Les médicaments tels qu’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique pourraient provoquer une insuffisance rénale chez les nourrissons et les enfants déshydratés.
Des signes de réaction allergique à ce médicament, y compris des problèmes respiratoires, un gonflement du visage et du cou (œdème de Quincke), des douleurs thoraciques ont été rapportés avec l’ibuprofène. Arrêtez immédiatement de prendre IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique et contactez immédiatement votre médecin ou allez au service des urgences de l’hôpital le plus proche si vous remarquez l’un de ces signes.
Soyez particulièrement prudent(e) avec IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique
Des réactions cutanées graves, y compris la dermatite exfoliative, l’érythème polymorphe, le syndrome de Stevens-Johnson, la nécrolyse épidermique toxique, la réaction d’hypersensibilité médicamenteuse avec éosinophilie et symptômes systémiques (DRESS ou syndrome d’hypersensibilité), la pustulose exanthématique aiguë généralisée (PEAG) ont été rapportées en association avec le traitement par l’ibuprofène. Arrêtez de prendre IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique et consultez immédiatement un médecin si vous notez l’un des symptômes liés à ces réactions cutanées graves décrites dans la rubrique 4.
Mises en garde spéciales
Si vous êtes une femme, IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique peut altérer votre fertilité. Son utilisation n'est pas recommandée chez les femmes qui souhaitent concevoir un enfant. Chez les femmes qui présentent des difficultés pour procréer ou chez lesquelles des examens sur la fonction de reproduction sont en cours, veuillez en parler à votre médecin ou votre pharmacien avant de prendre IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique.
Les sujets âgés présentent un risque plus élevé d'effets indésirables, en particulier pour les hémorragies gastro-intestinales, ulcères et perforations. Les fonctions rénales, hépatiques et cardiaques doivent être étroitement surveillées. La posologie doit être la plus faible possible pendant la durée la plus courte nécessaire au soulagement des symptômes.
AVANT D'UTILISER CE MEDICAMENT, CONSULTEZ VOTRE MEDECIN EN CAS :
· d'antécédent d'asthme associé à une rhinite chronique, une sinusite chronique ou des polypes dans le nez. L'administration de cette spécialité peut entraîner une crise d'asthme, notamment chez certains sujets allergiques à l'acide acétylsalicylique (aspirine) ou à un anti-inflammatoire non stéroïdien (voir rubrique « Ne prenez jamais IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique ») ;
· de troubles de la coagulation, de prise d'un traitement anticoagulant. Ce médicament peut entraîner des manifestations gastro-intestinales graves ;
· d'antécédents digestifs (hernie hiatale, hémorragie digestive, ulcère de l'estomac ou du duodénum anciens) ;
· de maladie du cœur, du foie ou du rein ;
· d'infection – veuillez consulter le chapitre « Infections » ci-dessous ;
· de varicelle. Ce médicament est déconseillé en raison d'exceptionnelles infections graves de la peau ;
· de traitement concomitant avec d'autres médicaments qui augmentent le risque d'ulcère gastroduodénal ou d’hémorragie, par exemple des corticoïdes oraux, des antidépresseurs (ceux de type ISRS, c'est à dire Inhibiteurs Sélectifs de la Recapture de la Sérotonine), des médicaments prévenant la formation de caillots sanguins tels que l'aspirine ou les anticoagulants tels que la warfarine. Si vous êtes dans un de ces cas, consultez votre médecin avant de prendre IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique (voir rubrique « Autres médicaments et IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique ») ;
· de traitement concomitant avec du méthotrexate à des doses supérieures à 20 mg par semaine ou avec du pémétrexed (voir rubrique « Autres médicaments et IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique »).
AU COURS DU TRAITEMENT, EN CAS :
· de troubles de la vue, PREVENEZ VOTRE MEDECIN ;
· d'hémorragie gastro-intestinale (rejet de sang par la bouche ou dans les selles, coloration des selles en noir), ARRETEZ LE TRAITEMENT ET CONTACTEZ IMMEDIATEMENT UN MEDECIN OU UN SERVICE MEDICAL D'URGENCE ;
· d’apparitions de signes cutanés ou muqueux qui ressemblent à une brûlure (rougeur avec bulles ou cloques, ulcérations), ARRETEZ LE TRAITEMENT ET CONTACTEZ IMMEDIATEMENT UN MEDECIN OU UN SERVICE MEDICAL D'URGENCE ;
· de signes évocateurs d'allergie à ce médicament, notamment une crise d'asthme ou brusque gonflement du visage et du cou (voir rubrique 4. « Quels sont les effets indésirables éventuels ? »), ARRETEZ LE TRAITEMENT ET CONTACTEZ IMMEDIATEMENT UN MEDECIN OU UN SERVICE MEDICAL D'URGENCE.
|
Ce médicament contient un anti-inflammatoire non stéroïdien : l'ibuprofène. Vous ne devez pas prendre en même temps que ce médicament d'autres médicaments contenant des anti-inflammatoires non stéroïdiens (y compris les inhibiteurs sélectifs de la cyclo-oxygénase 2) et/ou de l'acide acétylsalicylique (aspirine). Lisez attentivement les notices des autres médicaments que vous prenez afin de vous assurer de l'absence d'anti-inflammatoires non stéroïdiens et/ou d'acide acétylsalicylique (aspirine). |
Infections
L’ibuprofène peut masquer des signes d'infections tels que fièvre et douleur. Il est donc possible que l’ibuprofène retarde la mise en place d’un traitement adéquat de l'infection, ce qui peut accroître les risques de complications. C’est ce que l’on a observé dans le cas de pneumonies d’origine bactérienne et d’infections cutanées bactériennes liées à la varicelle. Si vous prenez ce médicament alors que vous avez une infection et que les symptômes de cette infection persistent ou qu’ils s'aggravent, consultez immédiatement un médecin.
Autres médicaments et IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, même s'il s'agit d'un médicament obtenu sans ordonnance.
CERTAINS MEDICAMENTS NE PEUVENT PAS ETRE UTILISES EN MEME TEMPS, ALORS QUE D'AUTRES MEDICAMENTS REQUIERENT DES CHANGEMENTS SPECIFIQUES (DE DOSE, PAR EXEMPLE).
Ce médicament contient un anti-inflammatoire non stéroïdien : l’ibuprofène.
Ce médicament ne doit pas être pris en association au mifamurtide.
Toujours informer votre médecin, dentiste ou pharmacien, si vous prenez un des médicaments suivants en plus d’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS SANS SUCRE, suspension buvable édulcorée au maltitol et à la saccharine sodique :
· aspirine (acide acétylsalicylique) ou d'autres anti-inflammatoires non stéroïdiens, incluant les inhibiteurs sélectifs de la cyclo-oxygenase-2 ;
· corticostéroïdes ;
· anticoagulants oraux comme la warfarine, héparine injectable, antiagrégants plaquettaires ou autres thrombolytiques comme la ticlopidine, et le lithium ;
· méthotrexate ;
· inhibiteurs de l'enzyme de conversion de l'angiotensine, diurétiques, bêta-bloquants et antagonistes de l'angiotensine II ;
· certains antidépresseurs (inhibiteurs sélectifs de la recapture de la sérotonine) ;
· pémétrexed ;
· ciclosporine, tacrolimus ;
· les médicaments utilisés pour traiter la douleur et l’inflammation (exemple : acide acétylsalicylique) à moins que de faibles doses aient été conseillées par le médecin ;
· des médicaments pour l'hypertension artérielle (inhibiteurs ECA, p.ex. le captopril, les bétabloquants, les antagonistes de l'angiotensine II) et même d'autres types de médicaments qui peuvent avoir une incidence ou dont leur action peut être affectée par le traitement par ibuprofène,
· glycosides cardiaques tels que la digoxine qui sont des médicaments utilisés dans de nombreuses pathologies cardiaques ;
· mifépristone (un médicament utilisé pour l’interruption de grossesse). Ne doit pas être utilisé dans les 8-12 jours après la prise de mifépristone, car l’effet de la mifépristone peut être réduit ;
· zidovudine (un médicament pour le traitement contre le sida) car avec l'utilisation d’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique, il existe un risque accru d'hémarthrose et d'hématomes chez les patients hémophiles atteints du VIH ;
· des quinolones (antibiotiques) étant donné que leur prise peut accroître les risques de convulsions ;
· nicorandil ;
· cobimétinib ;
· ténofovir disoproxil ;
· médicaments mixtes adrénergiques-sérotoninergiques ;
· pentoxifylline.
IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS SANS SUCRE, suspension buvable édulcorée au maltitol et à la saccharine sodique avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre tout médicament.
Grossesse
A partir du début du 6ème mois (24ème semaine d’aménorrhée) jusqu’à la fin de la grossesse, IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique est contre-indiqué. Au cours de cette période, vous ne devez EN AUCUN CAS prendre ce médicament, car ses effets sur votre enfant à naître peuvent avoir des conséquences graves voire fatales. Notamment, il a été observé une toxicité pour le cœur, les poumons et/ou les reins, et cela même avec une seule prise. Cela peut également avoir des répercussions sur vous et votre bébé en favorisant les saignements et entraîner un accouchement plus tardif ou plus long que prévu.
Avant le début du 6ème mois (jusqu’à la 24ème semaine d’aménorrhée) ou si vous envisagez une grossesse, vous ne devez pas prendre ce médicament, sauf en cas d’absolue nécessité. Celle-ci sera déterminée par votre médecin. Le cas échéant, la dose devra être la plus faible possible et la durée du traitement la plus courte possible.
En effet, les AINS, dont fait partie IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique, peuvent causer des fausses couches et pour certains, des malformations après une exposition en début de grossesse.
À partir de 2 mois et demi de grossesse (12 semaines d’aménorrhée), IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique peut provoquer des problèmes rénaux chez votre bébé, s’il est pris pendant plusieurs jours, ce qui peut entraîner un faible niveau du liquide amniotique dans lequel il se trouve (oligoamnios).
Dès le début du 5ème mois de grossesse (20 semaines d’aménorrhée), un rétrécissement des vaisseaux sanguins au niveau du cœur de votre bébé (constriction du canal artériel) peut s’observer. Si un traitement de plusieurs jours est nécessaire pendant le 5ème mois de grossesse (entre 20 et 24 semaines d’aménorrhée), votre médecin peut recommander une surveillance supplémentaire.
Si vous avez pris ce médicament alors que vous étiez enceinte, parlez-en immédiatement à votre médecin, afin qu’une surveillance adaptée vous soit proposée si nécessaire.
Allaitement
Ce médicament passant dans le lait maternel, il est déconseillé de l'utiliser pendant l'allaitement.
Fertilité
Ce médicament, comme tous les anti-inflammatoires non stéroïdiens (AINS), peut altérer la fertilité des femmes et entraîner des difficultés pour devenir enceinte, de façon réversible à l’arrêt du traitement. Informez votre médecin si vous planifiez une grossesse ou si vous avez des difficultés à concevoir.
Conduite de véhicules et utilisation de machines
Dans de rares cas, la prise de ce médicament peut entraîner des vertiges et des troubles de la vue.
IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique contient du benzoate de sodium, du sodium, du maltitol et de l’azorubine (E122)
Ce médicament contient 0,5 mg de benzoate de sodium par graduation de 1 kg. Le benzoate de sodium peut accroître le risque d’ictère (jaunissement de la peau et des yeux) chez les nouveau-nés (jusqu’à 4 semaines).
Ce médicament contient 3,79 mg de sodium (composant principal du sel de cuisine) par mL de suspension buvable. A prendre en compte chez les patients suivant un régime hyposodé strict. Si votre médecin vous a informé(e) d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient un agent colorant azoïque (azorubine E122) et peut provoquer des réactions allergiques.
Réservé au nourrisson de plus de 5 kg (et de plus de 3 mois) et à l'enfant de moins de 12 ans (environ 30 kg).
Veillez à toujours faire prendre ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Pour atténuer les symptômes, la dose efficace la plus faible devra être utilisée pendant la durée la plus courte possible. Si vous avez une infection et que les symptômes (tels que fièvre et douleur) persistent ou qu’ils s'aggravent, consultez immédiatement un médecin (voir rubrique 2).
Posologie
Nourrissons de moins de 5 kg (ou de moins de 3 mois)
Ce médicament ne doit pas être utilisé chez les enfants de moins de 5 kg (ou de moins de 3 mois). Adressez-vous à votre médecin ou votre pharmacien.
Nourrissons de plus de 5 kg (et plus de 3 mois) et enfants de moins de 12 ans (environ 30 kg)
Douleur et/ou fièvre :
La posologie usuelle est de 20 à 30 mg/kg/jour en 3 prises par jour (sans dépasser 30 mg/kg/jour).
Les prises systématiques, espacées de 8 heures, permettent d'éviter les pics de douleur ou de fièvre.
Vous devez vous adresser à votre médecin si votre enfant se sent moins bien, ou s’il ne ressent aucune amélioration :
· après 24 heures chez les nourrissons (de 3 mois à 2 ans) ;
· après 3 jours chez les enfants âgés de plus de 2 ans.
Arthrite chronique juvénile :
· la posologie usuelle est de 30 à 40 mg/kg/jour en 4 prises par jour.
Mode d’administration
Voie orale.
Le médicament s'administre au moyen de la seringue pour administration orale (graduée en kg) qui délivre une dose de 10 mg/kg par prise.
L'usage de la seringue pour administration orale est strictement réservé à l'administration d’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique.
La dose à administrer pour 1 prise est obtenue en aspirant la suspension en tirant le piston de la seringue pour administration orale jusqu'à la graduation correspondant au poids de l'enfant.
Pour chaque prise :
· de 5 à 10 kg : remplir la seringue jusqu'à la graduation indiquant le poids de l'enfant ;
· au-delà de 10 kg : remplir une première fois la seringue jusqu'à la graduation 10 kg, puis une deuxième fois jusqu'à atteindre un total égal au poids de l'enfant (exemple pour un enfant de 15 kg : remplir une première fois la seringue jusqu'à la graduation 10 kg puis une deuxième fois jusqu'à 5 kg) ;
· au-delà de 30 kg (soit environ 12 ans) : il existe des formes pharmaceutiques plus adaptées.
Instructions pour l'utilisation et la manipulation de la seringue pour administration orale :
· bien agiter le flacon avant emploi ;
· pour ouvrir le flacon, tourner le bouchon sécurité-enfant en appuyant. Le flacon doit être refermé après chaque utilisation ;
· l'usage de la seringue pour administration orale est strictement réservé à l'administration de cette suspension pédiatrique d'ibuprofène ;
· la seringue pour administration orale doit être démontée, rincée et séchée après utilisation.
Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Si vous avez donné plus d’IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique que vous n’auriez dû, ou si des enfants ont pris le médicament accidentellement
Contactez toujours un médecin ou l’hôpital le plus proche afin d’obtenir un avis sur le risque et des conseils sur les mesures à prendre.
Les symptômes d’un surdosage peuvent inclure nausées, douleurs abdominales, vomissements (pouvant contenir des traces de sang), saignements gastro-intestinaux (voir également la rubrique 4 ci-dessous), diarrhées, maux de tête, bourdonnements dans les oreilles, confusion et mouvements oculaires instables. Une agitation, une somnolence, une désorientation ou un coma peuvent également se produire. Parfois les patients développent des convulsions. À fortes doses, les symptômes suivants ont été signalés : somnolence, douleur thoracique, palpitations, perte de conscience, convulsions (principalement chez les enfants), faiblesse et étourdissements, sang dans les urines, faible taux de potassium dans votre sang, sensation de froid corporel et problèmes respiratoires. De plus, le temps de prothrombine/INR peut être prolongé, probablement en raison d'une interférence avec les actions des facteurs de coagulation circulants. Une insuffisance rénale aiguë et des lésions hépatiques peuvent survenir. Une exacerbation de l'asthme est possible chez les asthmatiques. En outre, il peut y avoir une hypotension artérielle et une diminution de la respiration.
Si vous oubliez de donner IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique
Si vous arrêtez de donner IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique
Sans objet.
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Arrêtez de prendre l’ibuprofène et consultez immédiatement un médecin si vous présentez l’un des symptômes suivants :
· taches rougeâtres non surélevées, en forme de cibles ou de cercles, sur le tronc, souvent accompagnées de cloques centrales, d’une desquamation de la peau, d’ulcères de la bouche, de la gorge, du nez, des organes génitaux et des yeux. Ces graves rash cutanés peuvent être précédés par de la fièvre et des symptômes grippaux (dermatite exfoliative, érythème polymorphe, syndrome de Stevens-Johnson, nécrolyse épidermique toxique) ;
· éruption cutanée généralisée, température corporelle élevée et gonflement des ganglions lymphatiques (DRESS ou syndrome d’hypersensibilité) ;
· éruption cutanée généralisée rouge et squameuse avec des bosses sous la peau et des vésicules s’accompagnant de fièvre. Les symptômes apparaissent généralement dès l’instauration du traitement (pustulose exanthématique aiguë généralisée).
La liste suivante d’effets indésirables peut se produire si vous êtes traité(e) avec de l'ibuprofène à court terme. Pour le traitement à long terme ou si votre médecin prescrit une dose plus élevée, d’autres effets indésirables peuvent se produire que ceux qui sont décrits ci-dessous.
Pour évaluer les effets secondaires, on se base sur les fréquences suivantes :
· Très fréquent : touche plus d'1 utilisateur sur 10
· Fréquent : touche 1 à 10 utilisateurs sur 100
· Peu fréquent : touche 1 à 10 utilisateurs sur 1000
· Rare : touche 1 à 10 utilisateurs sur 10 000
· Très rare : touche moins d'1 utilisateur sur 10 000
· Fréquence indéterminée : la fréquence est impossible à estimer d'après les données disponibles
En cas d'apparition de l'un des effets secondaires suivants, ou en cas d'aggravation de l'un d'eux ou si vous remarquez des effets non mentionnés ici, veuillez en informer votre médecin.
Troubles sanguins
Très rare : problèmes dans la production de cellules sanguines, les premiers signes sont : fièvre, maux de gorge, ulcères superficiels de la bouche, symptômes grippaux, fatigue extrême, saignement nasal et cutané. Dans ces cas, vous devez arrêter le traitement immédiatement et consulter un médecin. Evitez toute automédication d'antidouleurs ou de médicaments qui font baisser la fièvre (médicaments antipyrétiques).
Problèmes du système immunitaire
Peu fréquent : réactions allergiques accompagnées de démangeaisons et d'urticaire, de crises d'asthme et difficultés respiratoires. Vous devez cesser la prise d’IBUPROFENE VIATRIS et informer votre médecin immédiatement.
Très rare : sévères réactions allergiques, les signes peuvent être : œdème du visage, de la langue et de la gorge, essoufflement, accélération du rythme cardiaque, hypotension artérielle, état de choc important. Si l'un de ces symptômes se produit, ce qui peut arriver même lors d'une première utilisation, l'assistance immédiate d'un médecin est requise.
Troubles du système nerveux
Peu fréquent : maux de tête.
Très rare : méningite aseptique.
Fréquence indéterminée : vertiges.
Troubles oculaires
Fréquence indéterminée : troubles visuels.
Troubles cardiaques
Fréquence indéterminée : défaillance cardiaque, œdème, douleur thoracique, qui peut être le signe d’une réaction allergique potentiellement grave appelée syndrome de Kounis.
Troubles vasculaires
Fréquence indéterminée : hypertension artérielle.
Troubles digestifs et intestinaux
Peu fréquent : douleurs abdominales, nausées et dyspepsie.
Rare : diarrhée, flatulence, constipation et vomissements.
Très rare : ulcère peptique, perforation et hémorragie gastro-intestinale, des selles noires goudronneuses, des vomissements de sang ou de particules sombres ressemblant à du café moulu, stomatite ulcérative, gastrite.
Fréquence indéterminée : aggravation d’une colite et maladie de Crohn.
Troubles hépatiques
Très rare : dommage du foie (les premiers signes peuvent être une décoloration de la peau).
Fréquence indéterminée : hépatite.
Affections cutanées
Peu fréquent : divers rashs cutanés.
Très rare : des formes sévères de réactions cutanées telles que réaction bulleuse y compris syndrome de Stevens-Johnson, érythème multiforme et syndrome de Lyell.
Fréquence indéterminée :
· complication infectieuse de la peau et des tissus mous pendant la varicelle ;
· une réaction cutanée sévère appelée syndrome d'hypersensibilité (en anglais : DRESS syndrome) peut survenir. Les symptômes d'hypersensibilité sont : éruption cutanée, fièvre, gonflement des ganglions lymphatiques et augmentation des éosinophiles (un type de globules blancs) ;
· éruption étendue squameuse rouge avec des masses sous la peau et des cloques principalement situées dans les plis cutanés, sur le tronc et sur les extrémités supérieures, accompagnée de fièvre à l’instauration du traitement (pustulose exanthématique aiguë généralisée). Si vous développez ces symptômes, arrêtez d’utiliser IBUPROFENE VIATRIS 20 mg/mL ENFANTS ET NOURRISSONS sans sucre, suspension buvable édulcorée au maltitol et à la saccharine sodique et consultez immédiatement un médecin (voir également rubrique 2) ;
· sensibilité de la peau à la lumière.
Troubles rénaux
Très rare : atteinte rénale, nécrose papillaire spécifiquement au cours de traitement à long terme associée à une augmentation de l’urémie et un œdème.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon. La date de péremption fait référence au dernier jour de ce mois.
N'utilisez pas ce médicament, si vous remarquez des signes visibles de détérioration du produit.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
· La substance active est :
ibuprofène.......................................................................................................................... 20,0 mg
pour 1 mL de suspension buvable.
· Les autres composants sont :
benzoate de sodium, acide citrique anhydre, citrate de sodium, saccharine sodique, chlorure de sodium, hypromellose, gomme xanthane, maltitol liquide, arôme fraise, azorubine (E122), glycérol, eau purifiée.
Ce médicament se présente sous forme de suspension buvable édulcorée au maltitol liquide et à la saccharine sodique. Flacon de 150 ou 200 mL.
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
ou
UNITHER LIQUID MANUFACTURING
1-3 Allée de la Neste
ZI d'en sigal
31770 COLOMIERS
Sans objet.
[A compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseils d’éducation sanitaire
QUE FAIRE EN CAS DE FIEVRE
La température normale du corps est variable d'un individu à l'autre et comprise entre 36,5°C et 37,5°C. Une élévation de plus de 0,8°C est considérée comme une fièvre.
· Chez le nourrisson (moins de 2 ans)
o La fièvre peut être dangereuse :
§ elle entraîne un risque de convulsion si elle monte trop et surtout trop vite,
§ elle entraîne un risque de déshydratation.
o Ce qu'il faut faire :
§ déshabiller l'enfant (un enfant nu dans une pièce à 20°C ne risque rien),
§ lui présenter souvent à boire (certains enfants boivent très peu mais très souvent),
§ éventuellement, baignez-le dans une eau dont la température est inférieure de 2°C à celle de l'enfant,
§ lui faire prendre un médicament contre la fièvre, après s'être assuré que le médicament est adapté au poids du nourrisson, en respectant les doses indiquées.
o Ce qu'il ne faut pas faire :
§ couvrir l'enfant, ce qui augmente le risque de convulsion et de déshydratation,
§ le mettre "à la diète".
o Consultez un médecin :
§ dans les heures qui suivent, si la température est élevée à plus de 38,5°C et si elle est accompagnée d'autres anomalies : comportement inhabituel (cris, pleurs, somnolence), vomissement, diarrhée.
· Chez l'enfant de plus de 2 ans
Si les troubles qu'elle entraîne sont trop gênants, vous pouvez donner un médicament contre la fièvre, après s'être assuré que le médicament est adapté au poids de l'enfant, en respectant les doses indiquées. Néanmoins :
o si d'autres signes apparaissent (comme une éruption cutanée), ou si la température persiste plus de 3 jours ou si elle s'aggrave, consultez un médecin,
o si les maux de tête deviennent violents, en cas de vomissements, consultez immédiatement un médecin.
QUE FAIRE EN CAS DE DOULEURS
Consultez un médecin :
· en l'absence d'amélioration au bout de :
o 24 heures chez le nourrisson de moins de 2 ans,
o 3 jours chez les enfants de plus de 2 ans ;
· si les douleurs reviennent régulièrement ;
· si elles s'accompagnent de fièvre ;
· si elles réveillent votre enfant la nuit.